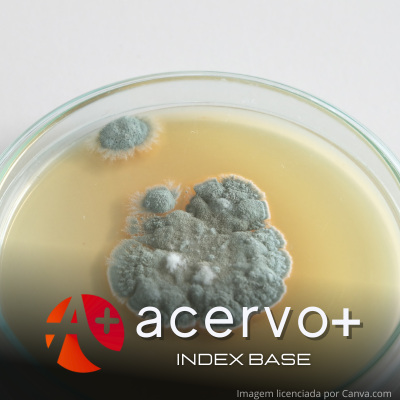
Identificação e quantificação de fungos e aflatoxinas em amendoins (Arachis hypogaea L)
##plugins.themes.bootstrap3.article.main##
Resumo
Objetivo: Identificar e quantificar fungos e aflatoxinas em amendoim (Arachis hypogaea L). Métodos: Foram analisadas 24 amostras, sendo: 14 in natura a granel, 5 industrializadas, e 5 torradas, adquiridas em comércios da cidade de São Luís - MA. O teor de umidade foi realizado segundo as "Normas Analíticas do Instituto Adolfo Lutz” e a quantificação de bolores, por método horizontal. A identificação das cepas, por Sistema MALDI-TOF e as aflatoxinas por LC MS/MS. Resultados: Os valores de umidade variaram de 3,1% a 8,1%, adequados para o controle de contaminantes fúngicos. Da contagem de bolores, apenas 15 amostras (62,5%) foram consideradas satisfatórias e adequadas, e 9 (37,5%) insatisfatórias e inadequadas. O Aspergillus flavus foi o mais evidenciado com 17 amostras (39,5%), seguida por Aspergillus montevidensis e Aspergillus niger 10 amostras (23,2%); Aspergillus mini sclerotigenes 3 amostras (6,9%); Aspergillus parasiticus, Purpureocillium lilacinun e Rhizopus sexualis em 01 amostra (6,9%). Nas aflatoxinas, 9 amostras (37,5%) apresentaram níveis detectáveis, que variaram de 1 a 82,3 µg/Kg, ou seja, as aflatoxinas não representam perigo para ingestão eventual, contudo, outras micotoxinas podem ser produzidas por essas espécies fúngicas. Conclusão: Novos estudos são necessários, para monitoramento do Aspergillus nos alimentos, ante os impactos envolvendo as mudanças climáticas sobre este gênero.
##plugins.themes.bootstrap3.article.details##
Copyright © | Todos os direitos reservados.
A revista detém os direitos autorais exclusivos de publicação deste artigo nos termos da lei 9610/98.
Reprodução parcial
É livre o uso de partes do texto, figuras e questionário do artigo, sendo obrigatória a citação dos autores e revista.
Reprodução total
É expressamente proibida, devendo ser autorizada pela revista.
Referências
2. AKINOLA EA, et al. Behaviour of Aspergillus parasiticus in aflatoxin production as influenced by storage parameters using response surface methodology approach. International Journal of Food Microbiology, 2021; 357: 109369.
3. ARAUJO IMS, et al. Características físico-químicas de sementes de diferentes genótipos de amendoim. Revista Brasileira de Biociencias, 2007; 5(S1): 870–872.
4. BETTIOL W e MEDEIROS FH V. Como o Brasil se tornou o maior produtor e consumidor de produtos de biocontrole. 2023. EMBRAPA. BR. Disponível em: https://www.embrapa.br/busca-de-noticias/-/noticia/79156418/artigo-como-o-brasil-se-tornou-o-maior-produtor-e-consumidor-de-produtos-de-biocontrole. Acessado em: 16 de setembro de 2023.
5. BRASIL. Ministério da Saúde. RESOLUÇÃO DA DIRETORIA COLEGIADA RDC No 138 DE 08 DE FEVEREIRO DE 2017.
6. BRASIL. MINISTÉRIO DA SAÚDE. Dispõe sobre limites máximos tolerados (LMT) para micotoxinas em alimentos. 2011. Disponível em: https://bvsms.saude.gov.br/bvs/saudelegis/anvisa/2011/res0007_18_02_2011_rep.html. Acessado em: 17 de março de 2023.
7. CARVALHO PER. Espécies arbóreas brasileiras. 2014; 1: 77.
8. CHOI Y, et al. Performance Evaluation of Bruker Biotyper, ASTA MicroIDSys, and VITEK-MS and Three Extraction Methods for Filamentous Fungal Identification in Clinical Laboratories. Journal of Clinical Microbiology, 2022; 60(11): e00812-22.
9. DA SILVA FC, et al. Taxonomiapolifásica para identificação de aspergillus seção flavi: uma revisão. Revista Ifes Ciência, 2015; 1(1): 18–40.
10. FLORIANO RF, et al. Effect of storage on the quality of peanut grain oil. Journal of Food Composition and Analysis, 2023; 124: 105688.
11. FRISVAD JC, et al. Taxonomy of Aspergillus section Flavi and their production of aflatoxins, ochratoxins and other mycotoxins. Studies Mycology, Taxonomy of Industrially Important Fungi, 2019; 93: 1–63.
12. GONÇALEZ E, et al. Produção de aflatoxinas e ácido ciclopiazônico por cepas de Aspergillus flavus isoladas de amendoim. Arquivos do Instituto Biológico, 2013; 80(3): 312–317.
13. IAL. Métodos Físico-Químicos para Análise de Alimentos. 1a, 2008 (Digital). Disponível em: analisedealimentosial_2008.pdf. Acessado em: 6 de abril de 2022.
14. IAMANAKA BT, et al. Micotoxinas em alimentos. Academia Pernambucana de Ciência Agronômica. 2010; 7: 138–161.
15. ISAAC GS, et al. Efficacy of Purpureocillium lilacinum AUMC 10149 as biocontrol agent against root-knot nematode Meloidogyne incognita infecting tomato plant. Brazilian Journal of Biology, 2021; 84: e253451.
16. JORNALISMO-ANALYTICA. A cromatografia líquida acoplada à espectrometria de massas em Tandem HPLC-MS/MS. 2020. Revista Analytica. 2023.
17. KATSIARI M, et al. Possible COVID-19-Associated Pulmonary Aspergillosis Due to Aspergillus niger in Greece. Antibiotics, 2022; 11(3): 300.
18. KHAN M e TANAKA K. Purpureocillium lilacinum for plant growth promotion and biocontrol against root-knot nematodes infecting eggplant. PLOS ONE, 2023; 18(3): e0283550.
19. MAIA BBF. Implementação dos métodos de deteção de cronobacter spp. E enumeração de fungos em géneros alimentícios no laboratório microchem. 2022.
20. MENEELY JP, et al. The Challenge of Global Aflatoxins Legislation with a Focus on Peanuts and Peanut Products: A Systematic Review. Exposure and Health, 2023; 15(2): 467–487.
21. MOREIRA FM, et al. Identificação de fungosfilamentosos em indústrias farmacêuticas: uma revisão integrativa da literatura. Revista Científica do UBM, 2021; 124–144.
22. MURRAY PR, et al. MicrobiologiaMédica. 6aed. Rio de Janeiro: Elsevier, 2009; 224p.
23. NIKOLIĆ M, et al. Toxigenic Species Aspergillus parasiticus Originating from Maize Kernels Grown in Serbia. Toxins, 2021; 13(12): 847.
24. NORLIA M, et al. Molecular Characterisation of Aflatoxigenic and Non-Aflatoxigenic Strains of Aspergillus Section Flavi Isolated from Imported Peanuts along the Supply Chain in Malaysia. Toxins, 2019; 11(9): 501.
25. OKUN DO, et al. Distribution of indigenous strains of atoxigenic and toxigenic Aspergillus flavus and Aspergillus parasiticus in maize and peanuts agro-ecological zones of Kenya. Agriculture & Food Security, 2015; 4(1): 14.
26. ORGANIZAÇÃO MUNDIAL DE SAÚDE (OMS). Mycotoxins. 2018. Disponível em: https://www.who.int/news-room/fact-sheets/detail/mycotoxins. Acessado em: 26 de agosto de 2023.
27. ROCHA MP, et al. Sistema de armazenamento e incidência dos principais fungos produtores de micotoxinas em grãos. Brazilian Journal of Development, 2020; 6(7): 50176–50193.
28. SAATH R, et al. Gestão da qualidade na pós-colheita do amendoim como ferramenta à competitividade. Revista em Agronegócio e MeioAmbiente, 2021; 14(1): e007927.
29. SAITA AC e PANDOLFI MAC. Efeitos da aflatoxina na comercialização do amendoim. 2019; 11.
30. SCHAMANN A, et al. Whole-Genome Sequences of Two Kenyan Aspergillus minisclerotigenes Strains. Microbiology Resource Announcements. 2023; 12(8): e00219-23.
31. ZHOU LW e MAY TW. Fungal taxonomy: current status and research agendas for the interdisciplinary and globalisation era. Mycology, 2023; 14(1): 52–59.
32. ZINGALES V, et al. Climate Change and Effects on Molds and Mycotoxins. Toxins, 2022; 14(7): 445.